Associação de anticorpos contra a Covid-19 é aprovado pela Anvisa
Ele será usado de forma emergencial para ajudar no tratamento contra a doença
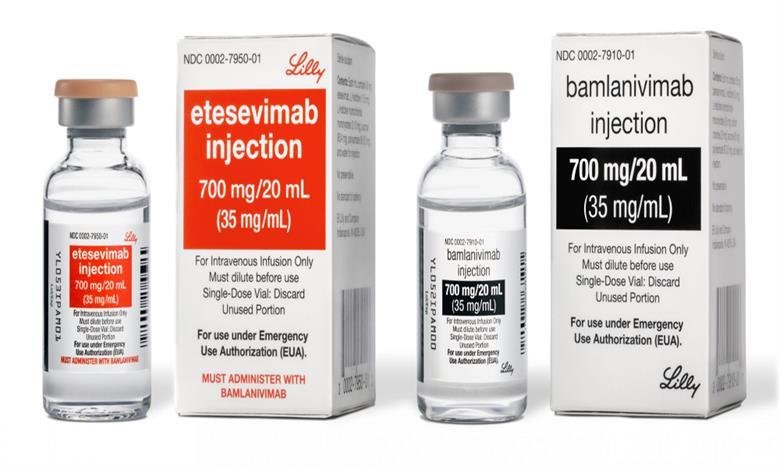
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou nesta quinta-feira (13), o uso emergencial da associação dos anticorpos banlanivimabe e etesevimabe no tratamento contra a Covid-19. O medicamento é produzido pela farmacêutica Eli Lilly do Brasil. A aprovação ocorreu na 8ª Reunião Extraordinária Pública da Diretoria Colegiada.
O que é o medicamento?
Banlanivimabe e etesevimabe são anticorpos monoclonais, ou seja, substâncias produzidas em laboratório que, injetadas no organismo, atuam como todos os outros anticorpos presentes no corpo humano, identificando e neutralizando agentes invasores nocivos à saúde.
Administrados juntos, em dose única, banlanivimabe e etesevimabe são indicados para o tratamento da covid-19 nas formas leve a moderada, em adultos e crianças com 12 anos ou mais e que pesem pelo menos 40 quilos. Esses pacientes devem apresentar ainda alto risco de progressão da doença para a forma grave ou que possa levar à necessidade de internação.
A associação não deve ser usada em pacientes que já estejam hospitalizados com Covid-19 ou que necessitem de oxigênio ou ventilação mecânica em seus tratamentos. O medicamento não poderá ser adquirido em farmácias. A autorização da Anvisa é para uso por hospitais. A incorporação no Sistema Único de Saúde (SUS) depende da avaliação do Ministério da Saúde.
Banlanivimabe e etesevimabe devem ser administrados em ambiente hospitalar por infusão intravenosa, o que significa que não é uma aplicação em seringa, mas similar às soroterapias. A infusão deve ser feita dentro de três dias do teste viral positivo e até dez dias após o início dos sintomas.
Eficácia e segurança
A eficácia do medicamento foi atestada por estudo clínico que apontou uma redução de 70% nos índices de hospitalização relacionada à Covid-19 e de óbitos por qualquer causa.
Por ser um medicamento aprovado em uso emergencial, a segurança e a eficácia dos anticorpos continuarão a ser avaliadas por estudos em andamento. Os possíveis efeitos adversos incluem reação alérgica, febre, calafrios e coceira.
Como foram observadas reações graves na administração de banlanivimabe, com ou sem etesevimabe, deverá ser incluída na bula do medicamento a seguinte observação: “Monitore clinicamente os pacientes durante a administração e observe os pacientes por pelo menos uma hora após a conclusão da infusão”.
Segunda associação de anticorpos contra a Covid-19
A associação banlanivimabe e etesevimabe é o segundo medicamento para uso emergencial aprovado no Brasil para o combate ao novo coronavírus. No dia 20 de abril, a Anvisa autorizou o uso da associação de outros anticorpos monoclonais: casirivimabe e imdevimabe, produzidos pelas farmacêuticas Regeneron e Roche.
As indicações e a forma de tratamento são praticamente as mesmas. A maior diferença entre os medicamentos é que o banlanivimabe e o etesevimabe não demonstraram capacidade de neutralizar a variante brasileira do novo coronavírus, que hoje é a cepa que prevalece no país. A Anvisa entendeu, porém, que se trata de um medicamento estratégico, com perfil de segurança favorável e dados relevantes no tratamento da covid-19. Além disso, ainda persiste um cenário de incertezas sobre o curso da pandemia, com alta taxa de transmissibilidade e óbitos.
Terceiro medicamento aprovado no Brasil contra o coronavírus
A Agência tinha aprovado no dia 12 de março o antiviral Rendesivir, um medicamento injetável produzido no formato de pó para diluição, que teve o registro concedido para o laboratório Gilead.
Assim, as associações de anticorpos monoclonais casirivimabe + imdevimabe e banlanivimabe + etesevimabe formam, com o Rendesevir, o trio de medicamentos com indicação aprovada para o tratamento da covid-19 no país.
A diretora Meiruze Freitas, relatora do processo que concluiu por autorizar o uso emergencial da associação banlanivimabe + etesevimabe, explicou que a decisão da Anvisa se orienta pela ponderação dos potenciais benefícios para a saúde pública em comparação aos eventuais riscos decorrentes da atuação sanitária.
“A expectativa com a autorização de uso emergencial e experimental de medicamentos contra a covid-19 é sempre ampliar as opções terapêuticas e, principalmente, aliviar a carga em nosso sistema de saúde, diminuindo o agravamento das condições clínicas de pacientes com covid-19 e o risco de morte. Compete a nós, servidores e diretores desta Agência, a missão de recorrer a todas as vias possíveis para fazer com que seja ampliada a lista de tratamentos disponíveis para os pacientes o mais rápido possível”, afirmou Meiruze.
Quais são considerados os pacientes com alto risco de progressão da covid-19 para a forma grave da doença?
Pacientes com alto risco são aqueles que atendam a pelo menos um dos critérios abaixo:
– Tenham mais de 65 anos de idade.
– Índice de massa corporal =35.
– Doença renal crônica.
– Diabetes.
– Enfermidade imunossupressora.
– Estejam recebendo tratamento imunossupressor.
– Possuam 55 anos de idade ou mais e tenham alguma das seguintes condições: doença cardiovascular, hipertensão, doença pulmonar obstrutiva crônica ou outra doença respiratória crônica.
– Tenham entre 12 e 17 anos de idade e apresentem alguma das seguintes comorbidades: anemia falciforme, doença cardíaca adquirida ou congênita, transtorno de neurodesenvolvimento, dependência relacionada a cuidado médico como traqueostomia, gastrostomia ou ventilação de pressão positiva. Desde que não seja relacionada à Covid-19, asma e hiper-reatividade de vias aéreas. Além disso, se houver outra doença respiratória crônica que requer medicação diária para controle.
LEIA TAMBÉM