Anvisa libera uso emergencial de anticorpo para tratamento contra Covid-19
Ele é encontrado apenas em hospitais e não é vendido em farmácias
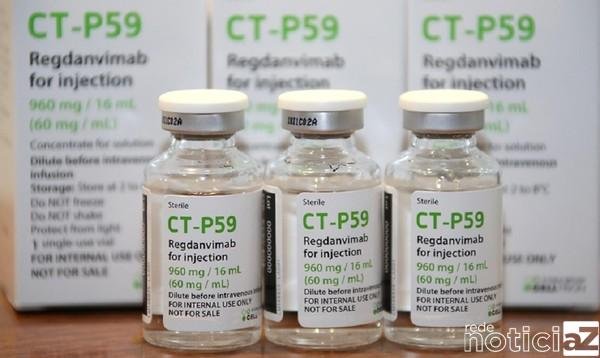
Nesta quarta-feira (11) a Agência Nacional de Vigilância Sanitária (Anvisa) autorizou o uso emergencial de um medicamento contra a Covid-19. É o Regkirona (regdanvimabe), um anticorpo monoclonal. Antes dele, o órgão já tinha liberado o uso dos medicamentos Regn-CoV2, desenvolvido pela farmacêutica Roche, e da associação dos anticorpos banlanivimabe e etesevimabe, produzido pela farmacêutica pela Eli Lilly. Além disso, autorizou o registro do antiviral experimental remdesivir.
Sobre o Regkirona, é um mecanismo que auxilia na reprodução de anticorpos que ajudam no combate a alguma doença específica. Contudo, o uso do medicamento não previne a doença. A diretora da Anvisa, Meiruze Freitas, também relatora falou da liberação do remédio, mas volta a pedir que a população se vacine contra a Covid-19.
”O ato de se vacinar é uma proteção individual e coletiva. Com a vacinação é que vamos combater a pandemia e reduzir os riscos de cepas que possam driblar as vacinas”, afirmou a relatora.
Em seu parecer, Freitas explicou que o medicamento não previne a doença, apenas ajuda no tratamento de pessoas já contaminadas que apresentam casos leves e moderados e que não necessitam de suplementação de oxigênio.
Conheça mais sobre o medicamento
- Anticorpo monoclonal único que têm como alvo a proteína espicular S do SARS-CoV-2;
- O tratamento é indicado para adultos que não necessitam de suplementação de oxigênio;
- Ele não é recomendado para pacientes graves;
- O tratamento deve ser iniciado assim que possível após o teste viral positivo para SARS-CoV-2 e dentro de 7 dias do início dos sintomas;
- Uso restrito a hospitais, sob prescrição médica e sua venda é proibida ao comércio;
- Não há eficácia clínica do produto contra a variante brasileira P1;
- Ainda não existem dados sobre o uso do medicamento em gestantes e lactantes;
- Ele não substitui as vacinas contra a Covid-19.
A aplicação é intravenosa, com dose única restrita a 40mg/kg, e o tratamento deve ser iniciado após o teste viral positivo para a Covid-19 e dentro de 7 dias do início dos sintomas. O uso é restrito a hospitais e a venda é proibida ao comércio. Já a incorporação no Sistema Único de Saúde (SUS) depende da avaliação do Ministério da Saúde.
A relatora explicou que a decisão da Anvisa se orienta pela ponderação dos potenciais benefícios para a saúde pública em comparação aos eventuais riscos decorrentes da atuação sanitária.
“Espero que essa autorização possa ajudar a aliviar a carga em nosso sistema de saúde. A Agência deve usar de todas as vias possíveis para fazer com que novos tratamentos estejam disponíveis para os pacientes o mais rápido possível. Que essa autorização de uso emergencial desse anticorpo monoclonal ofereça ao profissional de saúde mais uma ferramenta no combate à pandemia”, afirmou Freitas.
Riscos
Segundo a Anvisa, há riscos quanto ao uso do medicamento em idosos e pessoas obesas.
Os fatores de risco também existem diante do uso do medicamento em indivíduos acima de 55 anos de idade que tenham doença cardiovascular ou doença pulmonar crônica, diabetes mellitus tipo 1 ou tipo 2, doença renal crônica, doença hepática crônica ou pessoas que estejam recebendo tratamento imunossupressor no momento.
LEIA TAMBÉM
Anvisa libera medicamento e aprova em definitivo a vacina de Oxford